یک تحقیق پیشگامانه که در مجله معتبر Nature منتشر شده، استراتژی جدید و امیدوارکنندهای را برای درمان یکی از چالشبرانگیزترین انواع سرطان ارائه میدهد: سرطان پروستات مقاوم به اختهسازی (CRPC). این مرحله پیشرفته از بیماری اغلب به درمانهای استاندارد مقاوم میشود، اما محققان ممکن است راهی برای معکوس کردن این فرآیند از طریق هدف قرار دادن یک پروتئین خاص پیدا کرده باشند.
مشکل: سرطانی که هویت خود را تغییر میدهد
سرطان پروستات معمولاً با درمانهایی که گیرنده آندروژن (AR) را مسدود میکنند، درمان میشود؛ گیرندهای که به رشد تومور دامن میزند. اگرچه این روشها در ابتدا مؤثر هستند، اما بسیاری از تومورها در نهایت مقاوم میشوند. یکی از دلایل اصلی این امر، پدیدهای به نام انعطافپذیری تباری (lineage plasticity) است. این یعنی سلولهای سرطانی میتوانند هویت خود را تغییر دهند و از یک آدنوکارسینوم استاندارد به زیرگروههای تهاجمیتر، مانند سرطان پروستات نورواندوکرین (CRPC-NE)، تبدیل شوند. این سلولهای تغییریافته دیگر به گیرنده آندروژن وابسته نیستند و این امر باعث میشود داروهای استانداردی مانند انزالوتامید بیاثر شوند و منجر به پیامدهای بالینی ضعیف برای بیماران گردد.
عامل اصلی: یک کلید اصلی اپیژنتیکی به نام NSD2
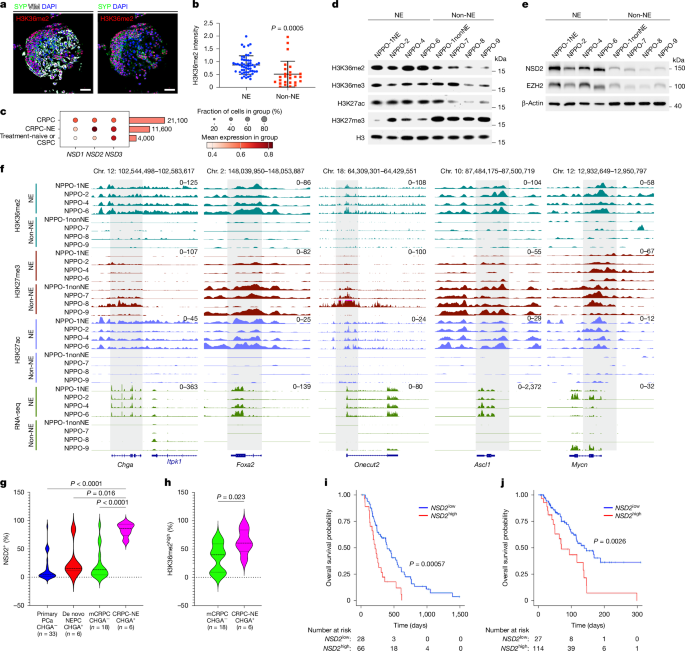
دانشمندان به بررسی مکانیسمهای زمینهای این تحول خطرناک پرداختند و دریافتند که یک آنزیم اپیژنتیکی به نام NSD2 در این سلولهای سرطانی تهاجمی و مقاوم به دارو به طور قابل توجهی افزایش مییابد. NSD2 یک هیستون متیلترانسفراز است، به این معنی که برچسبهای شیمیایی را به پروتئینهایی به نام هیستونها که DNA ما را بستهبندی میکنند، اضافه میکند. به طور خاص، NSD2 علامتی به نام H3K36me2 را اضافه میکند.
این علامت اپیژنتیکی مانند یک کلید عمل کرده و شبکهای کامل از ژنها را فعال میکند که باعث تحول به حالت نورواندوکرین میشوند. این مطالعه نشان داد که سطوح بالای NSD2 و علامت H3K36me2 آن، ارتباط مستقیمی با CRPC-NE و کاهش بقای بیماران دارد.
بازگرداندن کلید: تغییر مجدد هویت سرطان
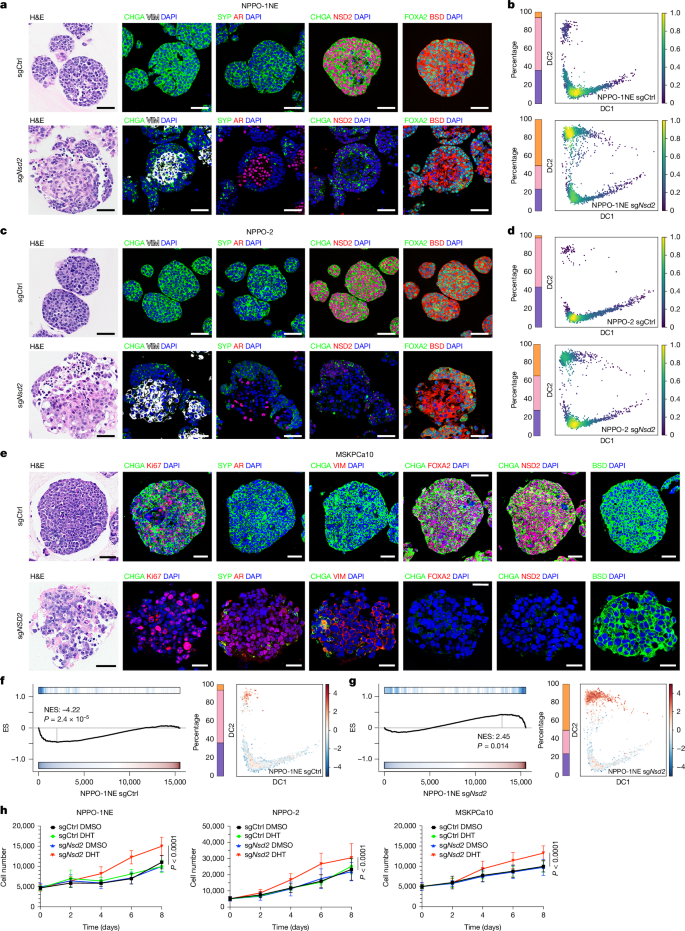
برای آزمایش اینکه آیا NSD2 برای حفظ این حالت تهاجمی ضروری است یا خیر، محققان از مدلهای آزمایشگاهی پیشرفته، از جمله ارگانوئیدهای تومور—تومورهای مینیاتوری که از مدلهای موشی و بیماران انسانی رشد داده شدهاند—استفاده کردند. آنها با استفاده از فناوری ویرایش ژن CRISPR، ژن NSD2 را در سلولهای سرطانی نورواندوکرین خاموش کردند.
نتایج شگفتانگیز بود. بدون NSD2، سلولهای تهاجمی CRPC-NE به فنوتیپ آدنوکارسینوم معمولی بازگشتند. آنها ویژگیهای نورواندوکرین خود را از دست دادند و مهمتر از همه، دوباره شروع به بیان گیرنده آندروژن (AR) کردند. این نشاندهنده یک معکوسسازی عمیق در انعطافپذیری تباری سرطان بود.
یک ترکیب دارویی جدید با همافزایی قدرتمند
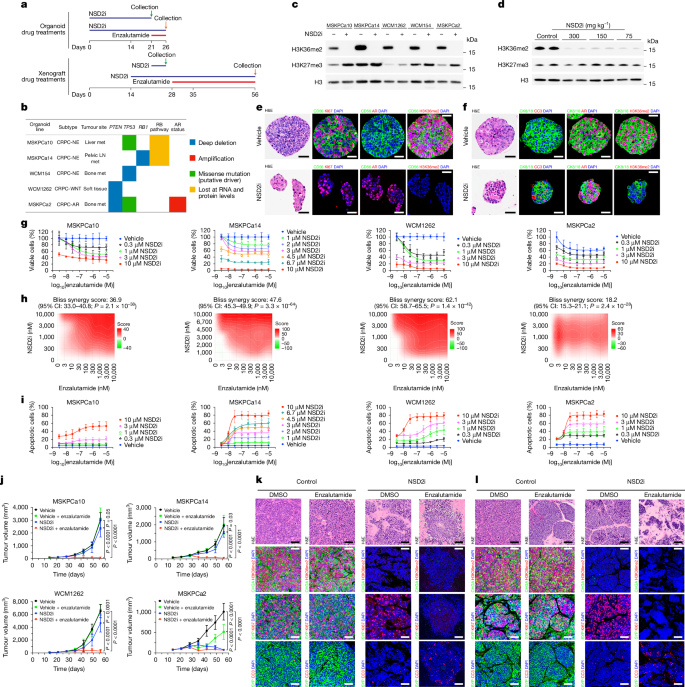
قدم بعدی این بود که ببینند آیا این بازگشت میتواند حساسیت به درمان را احیا کند یا خیر. تیم تحقیقاتی یک داروی مولکول کوچک جدید، یک مهارکننده NSD2 (NSD2i)، را برای مسدود کردن فعالیت این آنزیم به صورت دارویی توسعه دادند. هنگامی که آنها مدلهای مختلف ارگانوئید CRPC انسانی—از جمله CRPC-NE و سایر زیرگروههای مقاوم—را با این مهارکننده درمان کردند، همان معکوسسازی انعطافپذیری را مشاهده کردند.
وقتی آنها مهارکننده NSD2 را با مهارکننده استاندارد AR، یعنی انزالوتامید، ترکیب کردند، اثر آن همافزا بود. تومورهایی که قبلاً به طور کامل به انزالوتامید مقاوم بودند، اکنون به شدت پاسخ دادند. این درمان ترکیبی نه تنها رشد تومور را سرکوب کرد، بلکه باعث مرگ سلولی قابل توجهی در سلولهای سرطانی (آپوپتوز) هم در کشتهای آزمایشگاهی و هم در مدلهای حیوانی (زنوگرافت) شد.
پیامدها برای آینده درمان سرطان
این تحقیق یک منطق پیشبالینی قدرتمند برای یک رویکرد درمانی جدید برای سرطان پروستات پیشرفته فراهم میکند. به جای تلاش صرف برای کشتن سلولهای مقاوم، این استراتژی قصد دارد آنها را به حالتی حساس به دارو بازبرنامهریزی کند. یافتهها نشان میدهد که هدفگیری همزمان NSD2 و AR میتواند یک درمان بسیار مؤثر برای اشکال کشنده CRPC باشد که در حال حاضر گزینههای درمانی محدودی دارند. به طور کلی، این مطالعه پتانسیل هدف قرار دادن انعطافپذیری تباری را به عنوان یک استراتژی درمانی برای سایر تومورهای جامد که مقاومت دارویی پیدا میکنند، برجسته میسازد.
برای مطالعه عمیقتر این پژوهش علمی، میتوانید مقاله کامل را از اینجا بخوانید: منبع: مجله Nature
