آیا تا به حال فکر کردهاید که یک دارو بتواند کاری بیشتر از مسدود کردن یک پروتئین معیوب انجام دهد؟ چه میشد اگر میتوانست سلول را متقاعد کند که آن پروتئین را به طور کامل دور بیندازد؟ این ایده اصلی پشت «تخریب هدفمند پروتئین» (TPD)، یک رویکرد انقلابی در پزشکی است. یک مطالعه جدید و پیشگامانه نشان میدهد که این اثر «پاکسازی» میتواند به روشهای غیرمنتظره و قدرتمندی رخ دهد، حتی با داروهایی که در اصل برای این منظور طراحی نشدهاند.
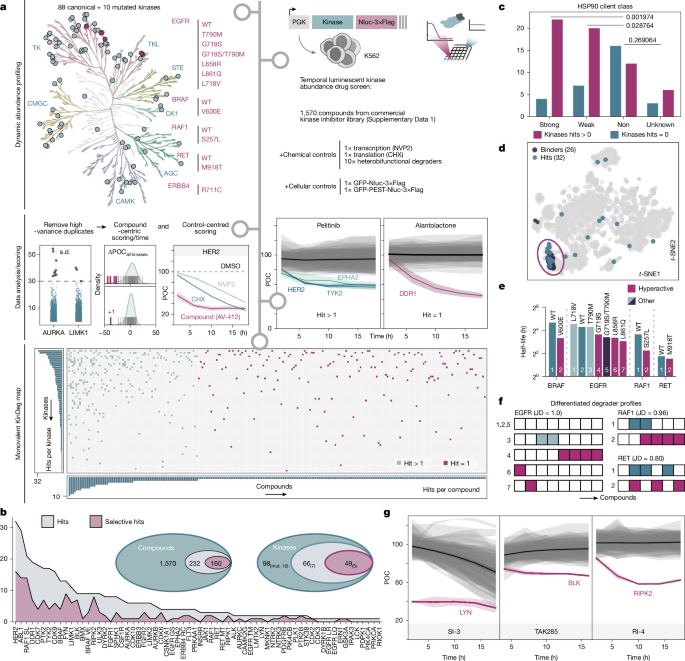
پژوهشگران یک پروژه عظیم را آغاز کردند و یک «نقشه تخریب» جامع ایجاد نمودند. آنها به طور سیستماتیک ۱٬۵۷۰ مهارکننده کیناز – داروهایی که برای مسدود کردن آنزیمهایی به نام کیناز طراحی شدهاند – را در برابر پروفایل فراوانی ۹۸ کیناز مختلف، از جمله ۱۰ نسخه جهشیافته که اغلب در بیماریها یافت میشوند، آزمایش کردند. غربالگری گسترده آنها ۲۳۲ ترکیب را شناسایی کرد که با موفقیت سطح حداقل یک کیناز را کاهش دادند و در مجموع بر روی ۶۶ کیناز مختلف تأثیر گذاشتند. این یافته تأیید کرد که تخریب هدف ناشی از مهارکننده یک تصادف نادر نیست، بلکه یک پدیده مکرر است.
یک مکانیسم شناختهشده برای این پدیده، «محرومسازی از چاپرون» است. بسیاری از کینازها برای حفظ شکل و پایداری مناسب خود به پروتئینهای «چاپرون» مانند HSP90 متکی هستند. برخی از مهارکنندهها میتوانند این رابطه محافظتی را مختل کرده و کیناز را در برابر ماشینآلات دفع سلول آسیبپذیر کنند. این مطالعه نشان داد کینازهایی که به عنوان مشتریان HSP90 شناخته میشوند، در واقع احتمال تخریب بیشتری داشتند، که این موضوع را به عنوان یک مکانیسم گسترده تأیید میکند. با این حال، این تمام داستان نبود.
محققان با کاوش عمیقتر، از یک اصل unifying و ظریفتر پرده برداشتند که آن را «اَبَرشارژ کردن» (supercharging) نامیدند. این مفهوم نشان میدهد که مهارکنندهها میتوانند یک کیناز را به حالت خاصی سوق دهند – با تغییر فعالیت، مکان یا تجمع آن – که مدارهای تخریب درونزای خود سلول از قبل برای شناسایی و حذف آن آماده شدهاند. به جای تحمیل یک فرآیند جدید، دارو به سادگی یک فرآیند طبیعی را تسریع میکند. برای نشان دادن این موضوع، آنها مکانیسمهای پشت سه تخریبکننده کیناز که قبلاً توصیف نشده بودند را به دقت تشریح کردند.
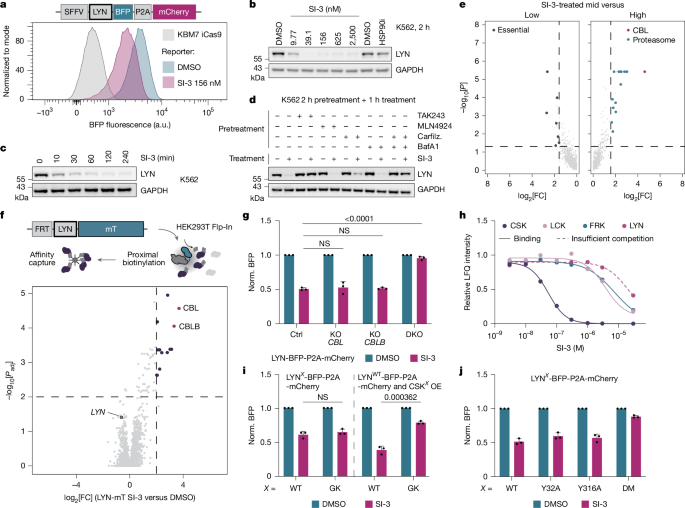
مورد اول: LYN و اثر شبکهای
مشخص شد که مهارکننده SI-3 باعث تخریب سریع و تقریباً کامل کیناز خانواده SRC به نام LYN میشود. برخلاف انتظار، تحقیقات نشان داد که قویترین هدف SI-3 خود LYN نیست، بلکه کیناز دیگری به نام CSK است که به عنوان یک ترمز طبیعی برای فعالیت LYN عمل میکند. با مهار CSK، SI-3 عملاً ترمز را آزاد کرده و باعث میشود LYN بیشفعال شود. این فعالیت بیش از حد، سیگنالی برای دو لیگاز E3 به نامهای CBL و CBLB است تا LYN را برای تخریب از طریق پروتئازوم و لیزوزوم نشانهگذاری کنند. این دارو هوشمندانه از شبکه تنظیمی داخلی سلول برای تحریک غیرمستقیم تخریب هدف خود بهره میبرد.
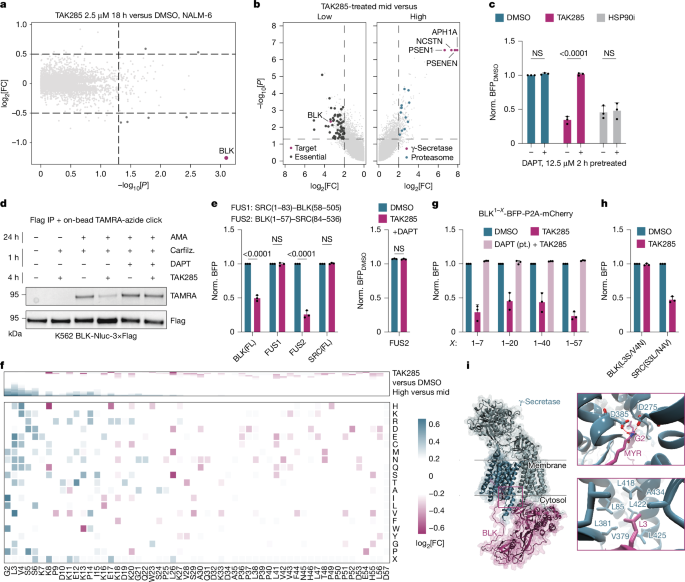
مورد دوم: BLK و تاکتیک جابجایی
مهارکننده TAK285 به طور انتخابی کیناز BLK را تخریب میکند. مکانیسم این فرآیند کاملاً غیرمنتظره بود. یک غربالگری CRISPR در سطح ژنوم نشان داد که این تخریب به کمپلکس γ-سکرتاز، یک پروتئاز درونغشایی، وابسته است. تحقیقات بیشتر نشان داد که TAK285 مستقیماً به BLK یا γ-سکرتاز متصل نمیشود. در عوض، یک اثر شبکهای را آغاز میکند که باعث میشود γ-سکرتاز لنگر میریستویلاسیون که BLK را به غشای سلول متصل میکند، قطع کند. پس از جدا شدن و شناور شدن در سیتوپلاسم، BLK ذاتاً ناپایدار شده و به سرعت تخریب میشود. این امر یک استراتژی جدید برای تخریب پروتئین را برجسته میکند: کنترل سرنوشت یک پروتئین از طریق دستکاری موقعیت زیرسلولی آن.
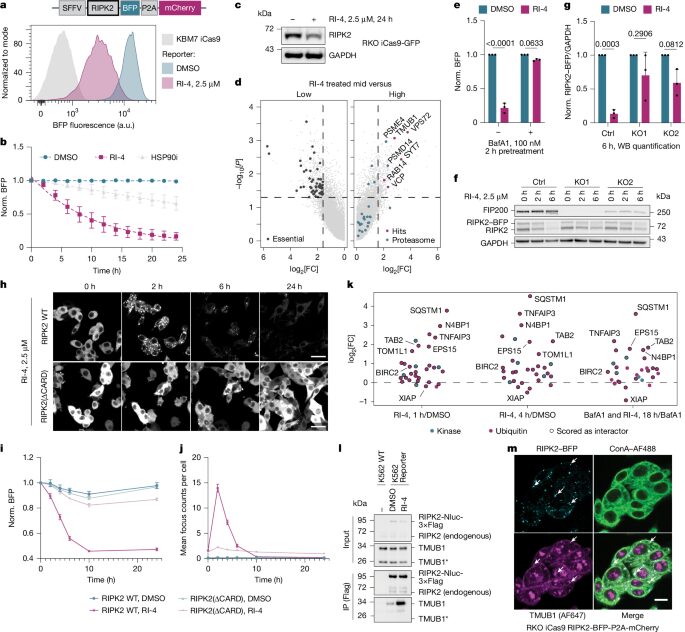
مورد سوم: RIPK2 و سیگنال تجمعی
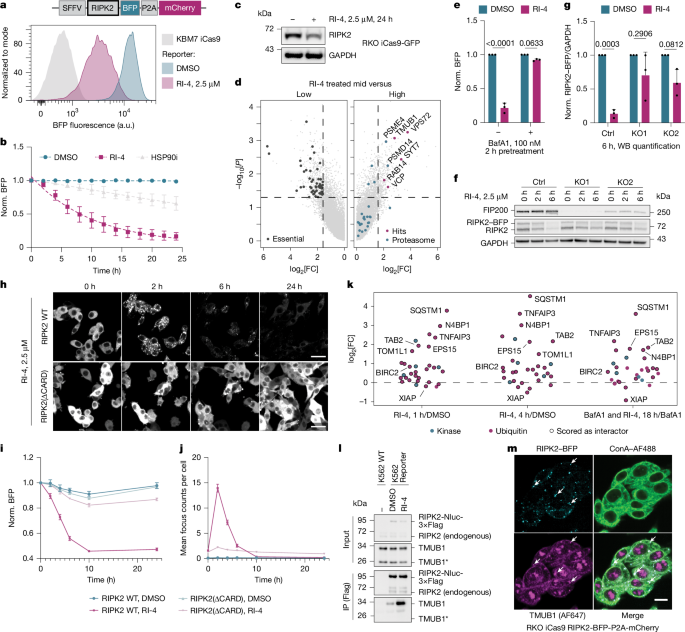
در نهایت، این مطالعه بر روی RI-4، یک مهارکننده که باعث تخریب RIPK2، کیناز دخیل در پاسخهای ایمنی، میشود، متمرکز شد. درمان با RI-4 باعث شد مولکولهای RIPK2 به تجمعات بزرگ و مرتبهای به نام «کانون» (foci) در داخل سلول تبدیل شوند. این ساختارها که توسط پروتئینی به نام TMUB1 تسهیل میشوند، «ریپوزومهایی» را تقلید میکنند که به طور طبیعی هنگام شناسایی پاتوژنهای باکتریایی توسط سلول تشکیل میشوند. سلول این تودههای ناشی از دارو را به عنوان یک سیگنال خطر تفسیر کرده و مسیر ماکرواُتوفاژی خود – یک سیستم بازیافت در مقیاس بزرگ – را برای بلعیدن و حذف آنها فعال میکند. این نشان داد که یک مهارکننده میتواند با القای یک حالت تجمعی خاص که یک مسیر پاکسازی فیزیولوژیکی را به خدمت میگیرد، تخریب را آغاز کند.
این پژوهش برجسته یک چارچوب یکپارچه برای درک تخریب ناشی از مهارکنندهها ارائه میدهد و نشان میدهد که این پدیده بسیار شایعتر و از نظر مکانیسمی متنوعتر از آن چیزی است که قبلاً تصور میشد. با یادگیری چگونگی «ابرشارژ کردن» سیستمهای دفع پروتئین طبیعی بدن، دانشمندان میتوانند داروهای هوشمندتر و مؤثرتری طراحی کنند که نه تنها پروتئینهای بیماریزا را مهار میکنند، بلکه آنها را از بین میبرند.
برای اطلاعات بیشتر، مطالعه کامل را از اینجا بخوانید: منبع